ngâm 1 vật bằng đồng có khối lượng 15g dd có chứa 0,12 mol AgNO3. sau 1 thời gian lấy vật ra thấy khối lượng AgNO3 trong dd giảm 25% . tính khối lượng của vật sau pứ

Những câu hỏi liên quan
Ngâm một vật bằng đồng có khối lượng 5gam trong 250 gam dd AgNO3 8%.Sau 1 thời gian ngắn,lấy vật ra thấy KL AgNO3 trong dd ban đầu giảm 85%.
a.Tính KL vật lấy ra sau khi lau khô.
b.Tính C% các chất trong dd sau PỨ
\(a,m_{AgNO_3}=250.8\%=20(g)\\ \Rightarrow m_{AgNO_3(p/ứ)}=20.85\%=17(g)\\ \Rightarrow n_{AgNO_3(p/ứ)}=\dfrac{17}{170}=0,1(mol)\\ PTHH:Cu+2AgNO_3\to Cu(NO_3)_2+2Ag\\ \Rightarrow \Delta m=0,1.108-0,05.64=7,6(g)\\ \Rightarrow m_{\text{vật lau khô sau p/ứ}}=7,6+5=12,6(g)\\ b,n_{Cu(NO_3)_2}=0,05(mol)\\ \Rightarrow C\%_{Cu(NO_3)_2}=\dfrac{0,05.188}{250}.100\%=3,76\%\\ m_{AgNO_3(dư)}=20-17=3(g)\\ \Rightarrow C\%_{AgNO_3}=\dfrac{3}{250}.100\%=1,2\%\)
Đúng 0
Bình luận (0)
Ngâm một vật bằng Cu có khối lượng 15g trong 340g dung dịch AgNO3 6%. Sau một thời gian lấy vật ra thấy khối lượng AgNO3 trong dung dịch giảm 25%. Khối lượng của vật sau phản ứng là
A. 15,26 g
B. 17,28 g
C. 16,15 g
D. 18,16g
Khối lượng của AgNOg trong dung dịch là:
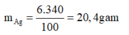
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
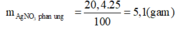
Từ (1)=> Số mol Cu đã phản ứng:
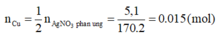
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.
Đúng 0
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 15 g trong 340 g dd AgNO3 6%. Sau một thời gian lấy vật ra thấy khối lượng trong dd giảm 25%. Khối lượng củ vật sau pứ là bao nhiêu?
Cu +2AgNO3 --> Cu(NO3)2 + 2Ag (*)
mAgNO3=\(\dfrac{340.6}{100}=20,4\left(g\right)\)
=>nAgNO3=0,12(mol)
=>mAgNO3(pư)=\(\dfrac{20,4}{100}.25=5,1\left(g\right)\)
nAgNO3(pư)=0,03(mol)
theo (*) : nAg=nAgNO3=0,03(mol)
nCu=1/2nAgNO3=0,015(mol)
=> mAg=3,24(g),mCu=0,96(g)
=> khối lượng của vật sau phản ứng là :
15+3,24=18,24(g)
Đúng 1
Bình luận (2)
Ngâm một vật bằng đồng có khối lượng 5g trong 250g dung dịch AgNO3 8%. Sau một thời gian, lấy vật ra và kiểm tra thấy lượng AgNO3 trong dung dịch đầu giảm 85%.
a) Tính khối lượng vật sau phản ứng? Biết bạc sinh ra bám vào vật.
b) Tính nồng độ % của các chất hòa tan trong dung dịch sau khi lấy vật ra.
LẸ . LÁT ĐI HỌC R
Ngâm 1 vật bằng Cu có khối lượng là 5 g vào 250 g AgNO3 4%, khi nhấc vật ra khỏi dd thì lương AgNO3 trong dd giảm đi 17%. Khối lượng của vật sau phản ứng?
\(m_{Cu\left(pư\right)}=a\left(g\right)\\ Cu+2AgNO_3->Cu\left(NO_3\right)_2+2Ag\\ m_{AgNO_3\left(pư\right)}=0,17.0,04.250:108=\dfrac{a}{64}\\ a=1\left(g\right)\\ m_{vật}=5-1+\dfrac{2}{64}.108=7,375g\)
Đúng 2
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 5g trong 250 g dung dịch AgNO3 8% chỉ sau một thời gian ngắn Lấy vật ra và kiểm tra thấy khối lượng AgNO3 trong dung dịch bắt đầu giảm 85%
a) tính khối lượng vật lý ra sao Khi lau khô
b) tính nồng độ phần trăm của các chất hòa tan trong dung dịch phản ứng sau khi Lấy vật ra
Khối lương AgNO3 = 250.4/100 = 10 gam; khối lượng AgNO3 giảm 17% có nghĩa là giảm 10.17/100 = 1,7 gam ---> số mol AgNO3 = 1,7/170 = 0,01 mol (tham gia phản ứng)
Cu + 2AgNO3 ------> Cu(NO3)2 + 2Ag
0,005 0,01 0,01
Khối lượng thanh Cu tăng thêm: 0,01.108 - 0,005.64 = 0,76 gam
Khối lượng vật sau pu là 10,76 gam
(Cứ tan ra 0,32 gam đồng thì sinh ra 1,08 gam Ag bám vào vật bằng Cu do đó vật tăng 10 + 0,76 gam)
Đúng 0
Bình luận (1)
Ngâm một vật bằng đồng có khối lượng 5g trong 500g dd AgNO3 4%. Chỉ sau một lúc người ta lấy vật ra và thấy khối lượng AgNO3 trong dd giảm mất 85%.a. Tính khối lượng vật lấy ra sau khi làm khô?b. Tính nồng độ phần trăm các chất trong dd sau khi lấy vật ra khỏi dd?CÁC BẠN GIẢI CHI TIẾT TỪNG BƯỚC DÙM MÌNH. CẢM ƠN RẤT NHIỀU
Đọc tiếp
Ngâm một vật bằng đồng có khối lượng 5g trong 500g dd AgNO3 4%. Chỉ sau một lúc người ta lấy vật ra và thấy khối lượng AgNO3 trong dd giảm mất 85%.
a. Tính khối lượng vật lấy ra sau khi làm khô?
b. Tính nồng độ phần trăm các chất trong dd sau khi lấy vật ra khỏi dd?
CÁC BẠN GIẢI CHI TIẾT TỪNG BƯỚC DÙM MÌNH. CẢM ƠN RẤT NHIỀU![]()
mAgNO3=500*4/100=20g
mAgNO3giảm=20*68/100=17g
=>nAgNO3=17/170=0.1 mol
PTHH: Cu + 2AgNO3 ------> Cu(NO3)2 + 2Ag
0.05 0.1 0.05 0.1
mCu = 0.05*64=3,2g
mAg =0.1*108= 10,8g
=>khối lượng vật là 5 + 10,8 - 3,2 = 12,6 g
b) từ từ anh làm nhé!!@
Đúng 1
Bình luận (3)
nAgNO3 = \(\frac{500.4\%}{170}\) = 2/17 mol
nCu = 0,078125 mol
Cu + 2AgNO3 => Cu(NO3)2 + 2Ag
0,05 <----0,1---------0,05-------> 0,1
m AgNO3 giảm = mAgNO3 pư = 2/17 . 85% = 0,1 mol
ta có m kim loại tăng = 0,05( 216-64) = 7,6
=> m vật = 5+ 7,6 = 12,6 (g)
nAgNO3 dư = \(\frac{2}{17}\) - 0,1 = \(\frac{3}{170}\)
mdd = 5+ 500 - 12,6 = 492,4
C% AgNO3 dư = \(\frac{\frac{3}{170}.170}{492,4}\) .100% = 0,609%
C% Cu(NO3)2 = \(\frac{0,05.188}{492,4}\) .100% = 1,9%
Đúng 1
Bình luận (2)
nAgNO3 = 500.4%170 = 2/17 mol
nCu = 0,078125 mol
Cu + 2AgNO3 => Cu(NO3)2 + 2Ag
0,05 <----0,1---------0,05-------> 0,1
m AgNO3 giảm = mAgNO3 pư = 2/17 . 85% = 0,1 mol
ta có m kim loại tăng = 0,05( 216-64) = 7,6
=> m vật = 5+ 7,6 = 12,6 (g)
nAgNO3 dư = 217 - 0,1 = 3170
Ta có mdd = 5+ 500 - 12,6 =492,4
C% AgNO3 dư = 3170.170492,4 .100% = 0,609%
C% Cu(NO3)2 = 0,05.188492,4 .100% = 1,9%
Đúng 0
Bình luận (0)
Bài 6: Ngâm một thanh kim loại bằng đồng có khối lượng 10gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra khỏi dd thì khối lượng dung dịch AgNO3 giảm 0,76 gam. Khối lựợng của thanh kim loại sau phản ứng là?
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒ Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
*Tk
Đúng 2
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 50gam vào 250 gam dung dịch AgNO3 6% khi Lấy vật ra thấy khối lượng AgNO3 trong dung dịch giảm 17%
a) Hãy xác định khối lượng của vật lấy ra sau phản ứng biết Ag sinh ra Bám vào vật
b) tính nồng độ phần trăm của chất có trong dung dịch sau phản ứng
a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%
Đúng 1
Bình luận (0)

























